Какое отношение имеет лактат (он же молочная кислота) к эмбрионам? Большинство людей знакомы с этой карбоновой кислотой только как с конечным продуктом расщепления глюкозы в результате гликолиза, который накапливается в мышцах, когда вы тренируетесь в тренажерном зале. Что ж, оказывается, лактат на самом деле – это ключевой регулятор функции эмбриона, и его новые роли проявляются по мере того, как улучшается наше понимание физиологии клетки. Другими словами, все гораздо серьезнее, чем мы думали изначально.
По репродуктивному тракту
In vivo овулированная яйцеклетка окружена «облаком» лактата. Он производится кумулюсными клетками, которые легко метаболизируют глюкозу в маточных трубах и вырабатывают как пируват, так и лактат (но лактата намного больше, чем пирувата)1. Кроме того, концентрация лактата в маточных трубах человека примерно в два раза выше, чем в матке. Следовательно, от оплодотворения до имплантации количество лактата, воздействующего на эмбрион, постоянно снижается (от 10 мМ на стадиях дробления в маточной трубе до 5 мМ – на стадии бластоцисты в матке). Очевидный вопрос: есть ли у этого лактатного «градиента» физиологическое значение? Чтобы приблизиться к ответу, мы должны рассмотреть физиологию и метаболизм ооцита и эмбриона (внимание, дальше будет немного биохимии).
Ооциты и эмбрионы привередливы в еде!
Ооцит и эмбрион на стадии дробления мало нуждаются в энергии (АТФ) из-за небольшого числа клеточных делений и, как следствие, ограниченного биосинтеза, поэтому для ооцитов и бластомеров характерны высокие уровни АТФ. Следующее, казалось бы, противоречит интуиции, но клетки с низким содержанием АТФ на самом деле энергетически очень активны, они быстро используют АТФ, который производят. Следовательно, на стадиях ооцита и дробления уровень АТФ выше, чем после компактизации эмбриона, когда из-за высоких метаболических требований для увеличения клеточных делений, биосинтеза и образования бластоцеля2 уровень АТФ3 значительно снижается. Как прямой результат высокого уровня АТФ на стадиях ооцита и дробления метаболизм глюкозы ингибируется из-за аллостерической регуляции ограничивающего скорость гликолитического фермента фосфофруктокиназы (PFK) 4. Таким образом, глюкоза не способна поддерживать ооциты после денудации или эмбрион на ранних стадиях, поскольку просто не может метаболизироваться, что объясняет потребность в пирувате и лактате5. Одновременно с активацией эмбрионального генома и увеличением потребности в энергии, связанной с более высокими уровнями биосинтеза и т. д., уровни АТФ падают, и ингибирование PFK повышается. Это приводит к высокому усвоению глюкозы после компактизации. Чрезвычайно интересным поворотом в истории метаболизма эмбриона становится судьба этой глюкозы (но подробнее об этом позже).
Итак, при оплодотворении и в результате дробления пируват представляет собой метаболит, который окисляется в небольших количествах с образованием АТФ для поддержки развития. Какова же связь между пируватом и лактатом? Две карбоновые кислоты находятся в равновесии, при этом фермент лактатдегидрогеназа (ЛДГ) взаимно превращает одну в другую, как показано на Рисунке 1.
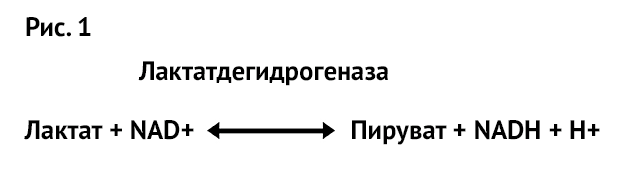
Очень важный факт об ЛДГ состоит в том, что он не только находится в равновесии (т. е. лактат и пируват легко меняются местами), но и то, что свободная энергия Гибба этой реакции близка к нулю, что при переводе на ненаучный язык означает: единственное, что влияет на то, образует ли лактат пируват или пируват образует лактат, – это относительная концентрация двух кислот. Таким образом, если концентрация лактата высока, тогда будет образовываться пируват, тогда как если лактат снижен, то и пирувата будет меньше. На самом деле это немного сложнее, но полезно понимать суть. Для эмбриона на ранней стадии развития среда с высоким содержанием лактата гарантирует образование пирувата. Однако все полностью меняется на стадии бластоцисты, когда глюкоза становится предпочтительным питательным веществом эмбриона. В соответствии с этим на мышах было продемонстрировано, что эмбрионы, которые культивировали в среде с высоким содержанием лактата и перенесли на 3-й день, были более жизнеспособны, чем эмбрионы, культивируемые в среде с низким содержанием лактата. Однако после компактизации происходило обратное, и жизнеспособность зависела от низкой концентрации лактата6.
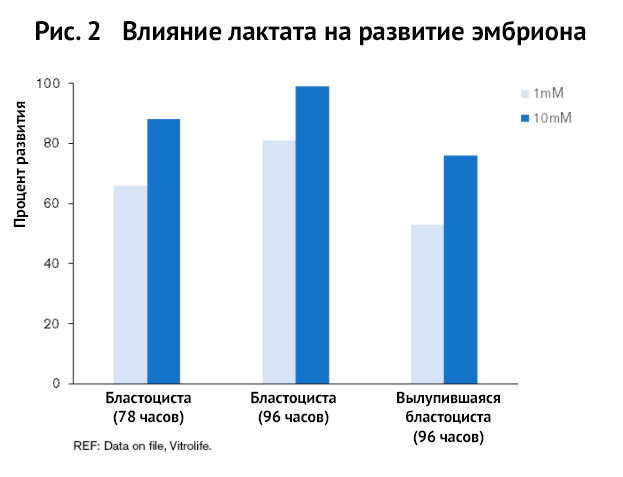
Рисунок 2 показывает, что низкая концентрация лактата при культивировании негативно влияет на развитие бластоцист.
Лактат и имплантация
В отличие от большинства соматических клеток, глюкоза, поглощаемая бластоцистой, не окисляется полностью. Вместо этого примерно половина потребляемой глюкозы превращается в лактат. Любопытно! Было установлено, что этот довольно необычный паттерн метаболизма также наблюдается в раковых клетках7,8 и называется аэробным гликолизом (не путать с анаэробным гликолизом, связанным с тренажерным залом). Первоначально считалось, что для поддержания биосинтеза требуется большое количество глюкозы, превышающее энергетические потребности клетки9. Однако впоследствии предположили, что вместо того, чтобы быть простым побочным продуктом потребления глюкозы, лактат сам по себе является ключевой сигнальной молекулой и участвует в трех основных аспектах имплантации, а именно инвазии, ангиогенезе и иммунной модуляции10. Другими словами, бластоцисты производят значительное количество лактата, чтобы создать микросреду с его высоким содержанием и, следовательно, низким pH, для облегчения имплантации.
Вывод
Становится ясно, что изменение концентрации лактата с высокой до низкой от оплодотворения до формирования бластоцисты действительно несет физиологический смысл. Большое содержание лактата на стадии дробления (~ 10 мМ) гарантирует, что эмбрион может использовать пируват, в то время как пониженный уровень лактата на стадии бластоцисты (~ 5 мМ) способствует имплантации. Так что в следующий раз, когда вы почувствуете жжение в мышцах после тренировки, возможно, вы по-новому посмотрите на молочную кислоту и оцените ее роль в зарождении жизни!






 Написать нам
Написать нам